
உள்ளடக்கம்
ஒரே தனிமத்தின் அனைத்து அணுக்களும் ஒரே எண்ணிக்கையிலான புரோட்டான்களைக் கொண்டிருந்தாலும், நியூட்ரான்களின் எண்ணிக்கை மாறுபடும். ஒரு குறிப்பிட்ட அணுவில் எத்தனை நியூட்ரான்கள் உள்ளன என்பதை அறிந்துகொள்வது, அந்த உறுப்பு அல்லது ஒரு ஐசோடோப்பில் துகள் வழக்கமானதா என்பதை தீர்மானிக்க உதவும், இது அதிகமாகவோ அல்லது குறைவாகவோ நியூட்ரான்களைக் கொண்டிருக்கும். ஒரு அணுவில் உள்ள நியூட்ரான்களின் எண்ணிக்கையைத் தீர்மானிப்பது மிகவும் எளிதானது மற்றும் எந்த பரிசோதனையும் தேவையில்லை. வழக்கமான அணு அல்லது ஐசோடோப்பில் உள்ள நியூட்ரான்களின் எண்ணிக்கையைக் கணக்கிட, ஒரு குறிப்பிட்ட அட்டவணையை கையில் வைத்து இந்த வழிமுறைகளைப் பின்பற்றவும்.
படிகள்
2 இன் முறை 1: பொதுவான அணுவில் உள்ள நியூட்ரல்களின் எண்ணிக்கையைக் கண்டறிதல்
கால அட்டவணையில் உறுப்பைக் கண்டறியவும். இந்த எடுத்துக்காட்டுக்கு, ஆறாவது வரிசையில் இருக்கும் OS (Os) ஐ மேலிருந்து கீழாகப் பார்ப்போம்.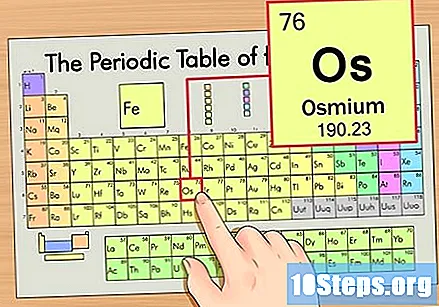
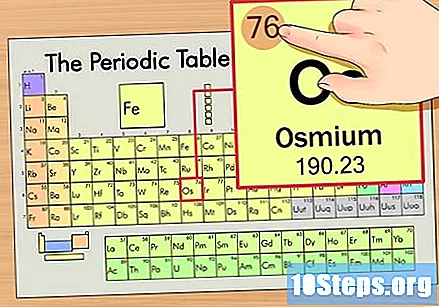
தனிமத்தின் அணு எண்ணைக் கண்டறியவும். இது வழக்கமாக ஒரு குறிப்பிட்ட உறுப்புக்கு மிகவும் புலப்படும் எண் மற்றும் பொதுவாக அதன் சின்னத்திற்கு மேலே இருக்கும் (நாம் பயன்படுத்தும் அட்டவணையில், உண்மையில், வேறு எந்த எண்ணும் பட்டியலிடப்படவில்லை). அணு எண் என்பது அந்த தனிமத்தின் ஒற்றை அணுவில் உள்ள புரோட்டான்களின் எண்ணிக்கை. ஒஸின் எண்ணிக்கை 76 ஆகும், அதாவது ஒரு ஆஸ்மியம் அணுவில் 76 புரோட்டான்கள் உள்ளன.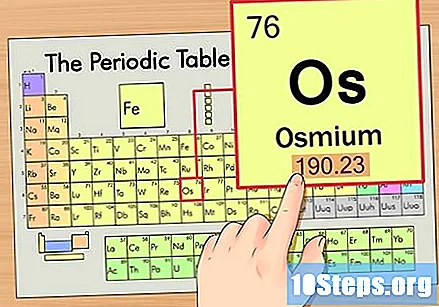
தனிமத்தின் அணு எடையைக் கண்டறியவும். இந்த எண் பொதுவாக அணு சின்னத்திற்கு கீழே காணப்படுகிறது. இந்த எடுத்துக்காட்டில் உள்ள அட்டவணை அணு எண்ணை மட்டுமே அடிப்படையாகக் கொண்டது மற்றும் அணு எடையை பட்டியலிடாது என்பதை நினைவில் கொள்க. இது எப்போதுமே அப்படி இருக்காது. ஆஸ்மியம் 190.23 என்ற அணு எடையைக் கொண்டுள்ளது.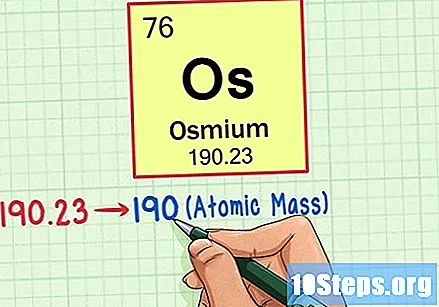
அணு வெகுஜனத்தைக் கண்டுபிடிக்க அணு எடையை அருகிலுள்ள முழு எண்ணுக்கு வட்டமிடுங்கள். எங்கள் எடுத்துக்காட்டில், 190.23 190 ஆக வட்டமிடப்படும், இதன் விளைவாக ஒஸ்மியத்திற்கு அணு நிறை 190 ஆகும்.- அணு நிறை என்பது தனிமத்தின் ஐசோடோப்புகளின் சராசரி. எனவே, இது பொதுவாக ஒரு முழு எண் அல்ல.
அணு வெகுஜனத்திலிருந்து அணு எண்ணைக் கழிக்கவும். ஒரு அணுவின் வெகுஜனத்தின் பெரும்பகுதி அதன் புரோட்டான்கள் மற்றும் நியூட்ரல்களில் காணப்படுவதால், அணு வெகுஜனத்திலிருந்து புரோட்டான்களின் எண்ணிக்கையை (அதாவது அணு எண்) கழிப்பதன் மூலம் உங்களுக்கு எண் கிடைக்கும் கணக்கிடப்பட்டது அணுவில் உள்ள நியூட்ரான்களின். தசம புள்ளிக்குப் பின் உள்ள எண் பொதுவாக அணுவில் உள்ள எலக்ட்ரான்களின் மிகச் சிறிய வெகுஜனத்தைக் குறிக்கிறது. எங்கள் எடுத்துக்காட்டில், இது: 190 (அணு நிறை) - 76 (புரோட்டான்களின் எண்ணிக்கை) = 114 (நியூட்ரான்களின் எண்ணிக்கை).
சூத்திரத்தை நினைவில் கொள்க. எதிர்காலத்தில் நியூட்ரான்களின் எண்ணிக்கையைக் கண்டுபிடிக்க, இந்த சூத்திரத்தைப் பயன்படுத்தவும்: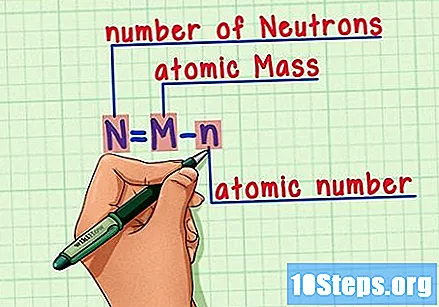
- N = M - n.
- N = எண் என்யூட்ரான்கள்.
- எம் = எம்அணு வறுவல்.
- n = nஅணு ஹியூமரஸ்.
- N = M - n.
முறை 2 இன் 2: ஒரு ஐசோடோப்பில் நியூட்ரான்களின் எண்ணிக்கையைக் கண்டறிதல்
கால அட்டவணையில் உறுப்பைக் கண்டறியவும். எடுத்துக்காட்டாக, கார்பன் -14 ஐசோடோப்பைப் பயன்படுத்துவோம். கார்பன் -14 இன் ஐசோடோபிக் அல்லாத வடிவம் வெறுமனே கார்பன் (சி) என்பதால், இந்த உறுப்பை கால அட்டவணையில் (இரண்டாவது வரிசையில்) கண்டறியவும்.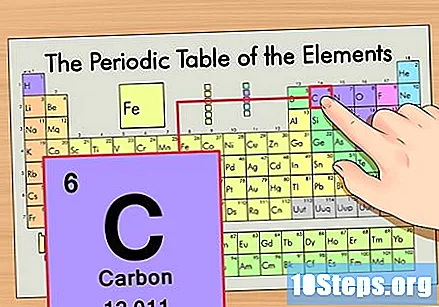
தனிமத்தின் அணு எண்ணைக் கண்டறியவும். இது வழக்கமாக ஒரு குறிப்பிட்ட உறுப்புக்கு மிகவும் புலப்படும் எண் மற்றும் பொதுவாக அதன் சின்னத்திற்கு மேலே இருக்கும் (நாம் பயன்படுத்தும் அட்டவணையில், உண்மையில், வேறு எந்த எண்ணும் பட்டியலிடப்படவில்லை). அணு எண் என்பது அந்த தனிமத்தின் ஒற்றை அணுவில் உள்ள புரோட்டான்களின் எண்ணிக்கை. சி என்பது எண் 6 ஆகும், அதாவது ஒரு கார்பன் அணுவில் 6 புரோட்டான்கள் உள்ளன.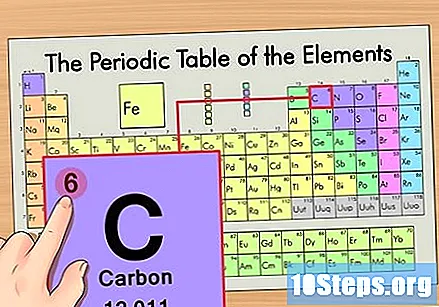
அணு வெகுஜனத்தைக் கண்டறியவும். ஐசோடோப்புகளுடன் இது நம்பமுடியாத எளிதானது, ஏனெனில் அவை அவற்றின் அணு வெகுஜனத்திற்கு பெயரிடப்பட்டுள்ளன. கார்பன் -14 ஒரு அணு நிறை 14 ஐக் கொண்டுள்ளது. ஐசோடோப்பின் அணு வெகுஜனத்தைக் கண்டறிந்ததும், நியூட்ரான்களின் எண்ணிக்கையைக் கண்டறியும் செயல்முறை சாதாரண அணுக்களுக்குப் பயன்படுத்தப்படும் அதே ஆகும்.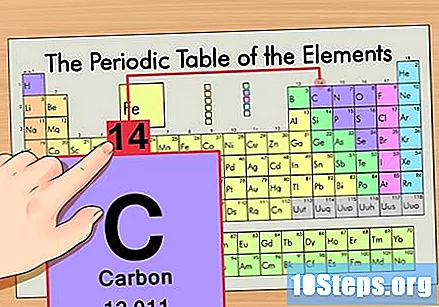
அணு வெகுஜனத்திலிருந்து அணு எண்ணைக் கழிக்கவும். ஒரு அணுவின் வெகுஜனத்தின் பெரும்பகுதி அதன் புரோட்டான்கள் மற்றும் நியூட்ரல்களில் காணப்படுவதால், அணு வெகுஜனத்திலிருந்து புரோட்டான்களின் எண்ணிக்கையை (அதாவது அணு எண்) கழிப்பதன் மூலம் உங்களுக்கு எண் கிடைக்கும் கணக்கிடப்பட்டது அணுவில் உள்ள நியூட்ரான்களின். தசம புள்ளிக்குப் பின் உள்ள எண் பொதுவாக அணுவில் உள்ள எலக்ட்ரான்களின் மிகச் சிறிய வெகுஜனத்தைக் குறிக்கிறது. எங்கள் எடுத்துக்காட்டில், இது: 14 (அணு நிறை) - 6 (புரோட்டான்களின் எண்ணிக்கை) = 8 (நியூட்ரான்களின் எண்ணிக்கை).
சூத்திரத்தை நினைவில் கொள்க. எதிர்காலத்தில் நியூட்ரான்களின் எண்ணிக்கையைக் கண்டுபிடிக்க, இந்த சூத்திரத்தைப் பயன்படுத்தவும்: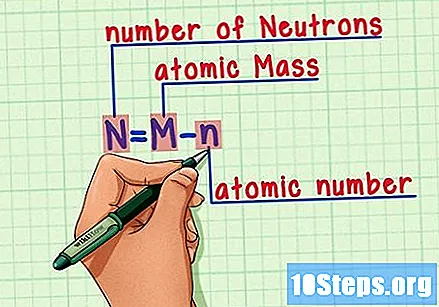
- N = M - n.
- N = எண் என்யூட்ரான்கள்.
- எம் = எம்அணு வறுவல்.
- n = nஅணு ஹியூமரஸ்.
- N = M - n.
உதவிக்குறிப்புகள்
- அறை வெப்பநிலையில் ஒரு திட உலோகமான ஒஸ்மியம் அதன் பெயரை கிரேக்க வார்த்தையான 'வாசனை', 'ஓஸ்மே' என்பதிலிருந்து பெறுகிறது.
- புரோட்டான்கள் மற்றும் நியூட்ரான்கள் கிட்டத்தட்ட உறுப்புகளின் முழு எடையையும் உருவாக்குகின்றன, அதே நேரத்தில் எலக்ட்ரான்கள் மற்றும் பிற மாறுபட்ட துகள்கள் ஒரு மிகக் குறைவான வெகுஜனத்தைக் குறிக்கின்றன (பூஜ்ஜிய வெகுஜனத்தை நெருங்குகின்றன). ஒரு புரோட்டான் நடுநிலையான அதே எடையையும், அணு எண் புரோட்டான்களின் எண்ணிக்கையையும் குறிப்பதால், மொத்த வெகுஜனத்திலிருந்து புரோட்டான்களின் எண்ணிக்கையை நாம் கழிக்க முடியும்.
- கால அட்டவணையில் எந்த எண் என்று உங்களுக்குத் தெரியாவிட்டால், இது வழக்கமாக அணு எண்ணைச் சுற்றி (அதாவது புரோட்டான்களின் எண்ணிக்கையை) உருவாக்கியது என்பதை நினைவில் கொள்ளுங்கள், இது 1 (ஹைட்ரஜன்) உடன் தொடங்கி ஒரு யூனிட் வரை உயரும் இடமிருந்து வலமாக, 118 இல் முடிவடைகிறது (Ununóctio). ஏனென்றால், ஒரு அணுவில் உள்ள புரோட்டான்களின் எண்ணிக்கை அந்த அணு என்ன என்பதை தீர்மானிக்கிறது, இது அடிப்படைக் குணாதிசயத்தை ஒழுங்கமைப்பதை எளிதாக்குகிறது (எடுத்துக்காட்டாக, 2 புரோட்டான்கள் கொண்ட ஒரு அணு எப்போதும் ஹீலியமாக இருக்கும், அதேபோல் 79 புரோட்டான்களைக் கொண்ட மற்றொரு அணு எப்போதும் தங்கமாக இருக்கும்).


