உள்ளடக்கம்
ஒரு வேதியியல் சேர்மத்தை உருவாக்கும் ஒவ்வொரு தனிமத்தின் சதவீதத்தையும் சதவீதம் நிறை தீர்மானிக்கிறது. இந்த மதிப்பைக் கண்டுபிடிக்க, கிராம் / மோல்களில் உள்ள கூட்டு கூறுகளின் மோலார் நிறை அல்லது தீர்வை உருவாக்க பயன்படுத்தப்படும் கிராம் எண்ணிக்கை உங்களுக்குத் தேவைப்படும். அடிப்படை வெகுஜனத்தை (அல்லது கரைப்பான்) கலவையின் வெகுஜனத்தால் (அல்லது தீர்வு) பிரிக்கும் அடிப்படை சூத்திரத்தைப் பயன்படுத்தி சதவீத வெகுஜனத்தை எளிய முறையில் கணக்கிட முடியும்.
படிகள்
2 இன் முறை 1: கொடுக்கப்பட்ட வெகுஜனங்களுடன் சதவீத வெகுஜனத்தைக் கண்டறிதல்
- ஒரு சேர்மத்தின் சதவீத வெகுஜனத்திற்கான சமன்பாட்டை வரையறுக்கவும். ஒரு சேர்மத்திற்கான அடிப்படை சூத்திரம்: சதவீதம் நிறை = () x 100. மதிப்புகளை சதவீதங்களாக வெளிப்படுத்த நீங்கள் முடிவை இறுதியில் 100 ஆல் பெருக்க வேண்டும்.
- நீங்கள் ஆர்வமுள்ள ஒரு வேதியியல் சேர்மத்தின் நிறை என்பது சிக்கலில் கொடுக்கப்பட்ட வெகுஜனமாகும். இந்த மதிப்பு வழங்கப்படாவிட்டால், பின்வரும் முறையைப் பார்க்கவும், நிறை வழங்கப்படாதபோது சதவீத வெகுஜனத்தை எவ்வாறு கண்டுபிடிப்பது என்பதை அறியவும்.
- கலவை அல்லது தீர்வை உருவாக்கப் பயன்படுத்தப்படும் அனைத்து உறுப்புகளின் வெகுஜனங்களைச் சேர்ப்பதன் மூலம் ஒரு சேர்மத்தின் மொத்த நிறை கணக்கிடப்படுகிறது.
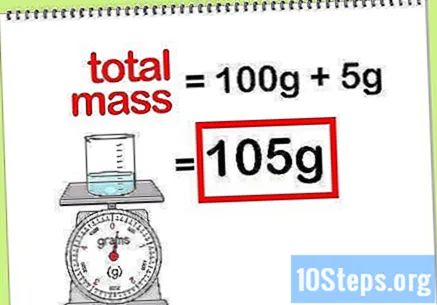
கலவையின் மொத்த வெகுஜனத்தைக் கணக்கிடுங்கள். சேர்க்கப்பட்ட அனைத்து கூறுகள் அல்லது சேர்மங்களின் வெகுஜன மதிப்பை நீங்கள் அறிந்தால், கலவையின் நிறை அல்லது இறுதி தீர்வைக் கணக்கிட அவற்றைச் சேர்க்க வேண்டும். இந்த மதிப்பு சதவீதம் வெகுஜனத்தின் கணக்கீட்டில் வகுக்கும்.- உதாரணத்திற்கு: 100 கிராம் தண்ணீரில் கரைந்த 5 கிராம் சோடியம் ஹைட்ராக்சைட்டின் சதவீதம் எவ்வளவு?
- கலவையின் மொத்த நிறை சோடியம் பெராக்சைடு மற்றும் நீரின் அளவு: 100 கிராம் + 5 கிராம், மொத்தம் 105 கிராம்.

கேள்விக்குரிய வேதிப்பொருளின் வெகுஜனத்தை அடையாளம் காணவும். நீங்கள் கண்டுபிடிக்க வேண்டிய போது சதவீதம் நிறை, அனைத்து உறுப்புகளின் மொத்த வெகுஜனத்தின் சதவீதமாக ஒரு குறிப்பிட்ட தனிமத்தின் (கேள்விக்குரிய உறுப்பு) வெகுஜனத்தைக் கண்டுபிடிக்க சிக்கல் விரும்புகிறது. கேள்விக்குரிய உறுப்பின் வெகுஜனத்தைக் கவனியுங்கள். இந்த மதிப்பு சதவீதம் வெகுஜன கணக்கீட்டில் எண்களாக இருக்கும்.- எடுத்துக்காட்டாக, தனிமத்தின் நிறை 5 கிராம் சோடியம் ஹைட்ராக்சைடு ஆகும்.
- சதவீத வெகுஜன சூத்திரத்தில் மாறிகள் மாற்றவும். ஒவ்வொரு மாறிக்கும் மதிப்புகளை தீர்மானித்த பிறகு, அவற்றை சமன்பாட்டில் மாற்றவும்.
- எடுத்துக்காட்டாக: சதவீதம் நிறை = () x 100 = () x 100.

சதவீத வெகுஜனத்தைக் கணக்கிடுங்கள். இப்போது சமன்பாடு உருவாகியுள்ளது, சதவீத வெகுஜனத்தைக் கணக்கிட அதைத் தீர்க்கவும். தனிமத்தின் வெகுஜனத்தை சேர்மத்தின் மொத்த வெகுஜனத்தால் வகுத்து 100 ஆல் பெருக்கவும். இதன் விளைவாக வேதியியல் தனிமத்தின் சதவீதம் நிறை இருக்கும்.- எடுத்துக்காட்டாக: () x 100 = 0.04761 x 100 = 4.751%. இவ்வாறு, 100 கிராம் நீரில் கரைந்த 5 கிராம் சோடியம் ஹைட்ராக்சைட்டின் சதவீதம் நிறை 4.751% ஆகும்.
முறை 2 இன் 2: கொடுக்கப்படாத வெகுஜனங்களுடன் சதவீத வெகுஜனத்தைக் கண்டறிதல்
- ஒரு சேர்மத்தின் சதவீத வெகுஜனத்திற்கான சமன்பாட்டை வரையறுக்கவும். ஒரு சேர்மத்தின் சதவீத வெகுஜனத்திற்கான அடிப்படை சூத்திரம்: சதவீதம் நிறை = () x 100. மதிப்புகளை சதவீதங்களாக வெளிப்படுத்த நீங்கள் முடிவை 100 ஆல் பெருக்க வேண்டும்.
- வெகுஜன மதிப்புகள் உங்களுக்குத் தெரியாதபோது, மோலார் வெகுஜனத்தைப் பயன்படுத்தி சேர்மத்தின் ஒரு தனிமத்தின் சதவீத வெகுஜனத்தைக் காணலாம்.
- உதாரணத்திற்கு: நீர் மூலக்கூறில் ஹைட்ரஜனின் சதவீதம் நிறை என்ன?.
எழுத வேதியியல் சூத்திரம். ஒவ்வொரு கலவைக்கும் ரசாயன சூத்திரங்கள் வழங்கப்படாவிட்டால், நீங்கள் அவற்றை எழுத வேண்டும். இல்லையெனில், "ஒவ்வொரு தனிமத்தின் வெகுஜனத்தைக் கண்டறியவும்" படிக்குச் செல்லவும்.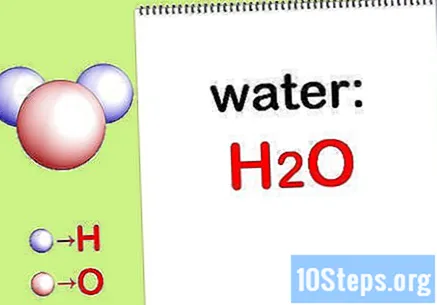
- உதாரணமாக, தண்ணீருக்கான வேதியியல் சூத்திரத்தை எழுதுங்கள்: எச்2தி.
கலவையில் ஒவ்வொரு தனிமத்தின் வெகுஜனத்தைக் கண்டறியவும். கால அட்டவணையைக் குறிப்பிடுவதன் மூலம் வேதியியல் சூத்திரங்களின் ஒவ்வொரு தனிமத்தின் மூலக்கூறு எடையைப் பாருங்கள். பொதுவாக, ஒரு தனிமத்தின் நிறை வேதியியல் உறுப்பு சின்னத்திற்கு கீழே காணப்படுகிறது. கலவையின் ஒவ்வொரு தனிமத்தின் வெகுஜனங்களைக் கவனியுங்கள்.
- எடுத்துக்காட்டாக, ஆக்ஸிஜனின் மூலக்கூறு நிறை 15.9994, மற்றும் ஹைட்ரஜனின் 1.0079 ஆகும்.
மோலார் விகிதத்தால் வெகுஜனங்களை பெருக்கவும். வேதியியல் சேர்மத்தில் ஒவ்வொரு தனிமத்தின் எத்தனை மோல்கள் உள்ளன என்பதை அடையாளம் காணவும். மோல்களின் எண்ணிக்கை சேர்மத்தின் சந்தா எண்ணால் வழங்கப்படுகிறது. ஒவ்வொரு தனிமத்தின் மூலக்கூறு வெகுஜனத்தையும் மோலார் விகிதத்தால் பெருக்கவும்.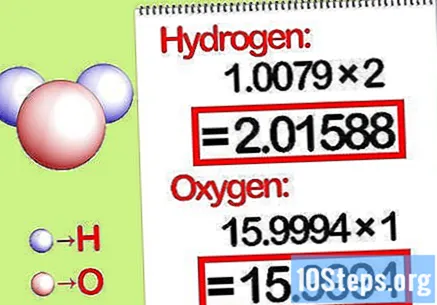
- எடுத்துக்காட்டாக, நீரில் ஹைட்ரஜனின் ஆக்ஸிஜனின் மோலார் விகிதம் 2: 1 ஆகும். எனவே, ஹைட்ரஜனின் மூலக்கூறு எடையை இரண்டு (1.00794 எக்ஸ் 2 = 2.01588) ஆல் பெருக்கி, ஆக்ஸிஜனின் மூலக்கூறு எடையை அப்படியே விட்டுவிடுங்கள் (15.9994).
கலவையின் மொத்த வெகுஜனத்தைக் கணக்கிடுங்கள். கலவையின் அனைத்து உறுப்புகளின் மொத்த வெகுஜனத்தைச் சேர்க்கவும். மோலார் விகிதத்தால் கணக்கிடப்பட்ட வெகுஜனங்களைப் பயன்படுத்தி, கலவையின் மொத்த வெகுஜனத்தைக் கணக்கிட முடியும். இந்த எண் சதவீதம் வெகுஜன சமன்பாட்டின் வகுப்பாக இருக்கும்.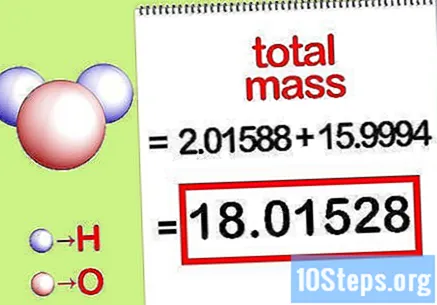
- எடுத்துக்காட்டாக, 15.9994 கிராம் / மோல் (ஆக்ஸிஜன் அணுவின் ஒற்றை மோலின் நிறை) உடன் 2.01588 கிராம் / மோல் (ஹைட்ரஜன் அணுக்களின் இரண்டு மோல்களின் நிறை) சேர்த்து 18.01528 கிராம் / மோல் கிடைக்கும்.
கேள்விக்குரிய தனிமத்தின் வெகுஜனத்தை அடையாளம் காணவும். நீங்கள் கண்டுபிடிக்க வேண்டிய போது சதவீதம் நிறை, அனைத்து உறுப்புகளின் மொத்த வெகுஜனத்தின் சதவீதமாக ஒரு கலவையில் ஒரு குறிப்பிட்ட தனிமத்தின் வெகுஜனத்தைக் கண்டுபிடிக்க சிக்கல் விரும்புகிறது. கேள்விக்குரிய தனிமத்தின் வெகுஜனத்தைக் கண்டறிந்து அதை எழுதுங்கள். இது மோலார் விகிதத்தைப் பயன்படுத்தி கணக்கிடப்படும் வெகுஜன மதிப்பு. இந்த மதிப்பு சதவீதம் வெகுஜன சமன்பாட்டின் எண்.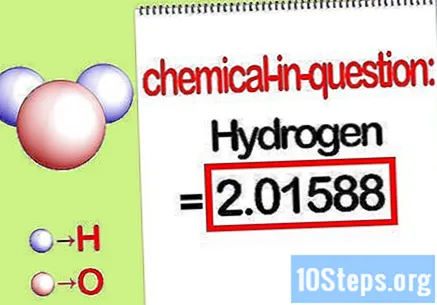
- எடுத்துக்காட்டாக, கலவையின் ஹைட்ரஜன் நிறை 2.01588 கிராம் / மோல் (ஹைட்ரஜன் அணுக்களின் இரண்டு மோல்களின் நிறை).
- சதவீத வெகுஜன சூத்திரத்தில் மாறிகள் மாற்றவும். ஒவ்வொரு மாறிக்கும் மதிப்புகளைத் தீர்மானித்த பிறகு, அவற்றை முதல் கட்டத்தில் வரையறுக்கப்பட்ட சமன்பாட்டில் மாற்றவும்: சதவீதம் நிறை = () x 100.
- எடுத்துக்காட்டாக: சதவீதம் நிறை = () x 100 = () x 100.
சதவீத வெகுஜனத்தைக் கணக்கிடுங்கள். இப்போது சமன்பாடு உருவாகியுள்ளது, சதவீத வெகுஜனத்தைக் கணக்கிட அதைத் தீர்க்கவும். தனிமத்தின் வெகுஜனத்தை சேர்மத்தின் மொத்த வெகுஜனத்தால் வகுத்து 100 ஆல் பெருக்கவும். இதன் விளைவாக வேதியியல் தனிமத்தின் சதவீதம் நிறை இருக்கும்.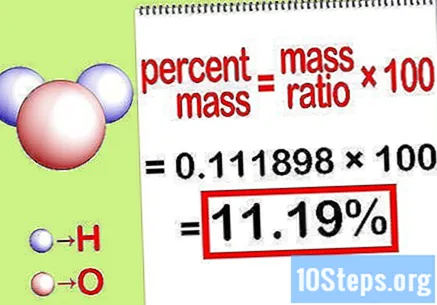
- எடுத்துக்காட்டாக, சதவீதம் நிறை = () x 100 = 0.111189 x 100 = 11.18%. ஆக, நீர் மூலக்கூறில் ஹைட்ரஜன் அணுக்களின் சதவீதம் நிறை 11.18% ஆகும்.